蓝莓苯丙氨酸解氨酶基因的克隆与表达载体构建
本作品内容为蓝莓苯丙氨酸解氨酶基因的克隆与表达载体构建,格式为 docx ,大小 45196 KB ,页数为 9页

('蓝莓苯丙氨酸解氨酶基因的克隆与表达载体构建徐亚维;尹锐;王俊玲【摘要】为进一步探讨苯丙氨酸解氨酶(PAL)基因的表达和研究其功能,采用通用植物总RNA提取试剂盒提取蓝莓果实总RNA,并根据同源基因设计相关引物,利用反转录PCR方法克隆苯丙氨酸解氨酶PAL编码基因,将其连接到pMD18-T载体上构建克隆载体并酶切鉴定.然后将PAL目的基因连接到pET-20b(+)上构建表达载体,并通过PCR检测和酶切双重方法鉴定.结果表明,成功获得了258bp大小的PAL片段,并成功构建表达载体.【期刊名称】《贵州农业科学》【年(卷),期】2015(043)012【总页数】4页(P26-29)【关键词】蓝莓;苯丙氨酸解氨酶;克隆;表达载体【作者】徐亚维;尹锐;王俊玲【作者单位】吉林农业科技学院生物工程学院,吉林吉林132101;吉林农业科技学院生物工程学院,吉林吉林132101;吉林农业科技学院生物工程学院,吉林吉林132101【正文语种】中文【中图分类】S663.9蓝莓为越橘属常绿灌木,其果皮呈蓝色或蓝黑色而被命名为蓝莓,并以富含抗氧化活性物质如黄酮类、花色苷、多酚类化合物以及维生素C等而著称[1]。吉林长白山分布着一部分中国野生越橘,其果实不但富含有维生素C、E、Zn等成分,还大量存在一种黄烷醇类多酚类化合物花青素(anthocyanidin),具有抗氧化、提高免疫力和消炎抗癌等多种生理功效。资料表明,蓝莓中的花青素含量居所有水果和蔬菜之首[2]。因此,开发蓝莓花青素成分并深入研究其结构及功能具有重要的现实意义,同时也能提高蓝莓本身的附加值和经济效益。目前,花青素生物合成及其调控机制的研究日益成为生命科学领域研究的热点之一。在蓝莓果实花青素生物合成途径中涉及到多种重要催化酶,其中较典型的催化酶有苯丙氨酸解氨酶(phenylalanineammonialyase,PAL)[3]、苯基苯乙烯酮黄烷酮异构酶(chalcone-flavanone,CHI)[4]和黄烷酮-3-羟化酶(flavanone3-hydroxylase,F3H)[5]。PAL作为花青素合成中第一步起关键作用的调控酶,催化L-苯丙氨酸解氨酶生成反式肉桂酸,再进而生成香豆酸、阿魏酸、芥子酸等中间产物,这些酸最后转化为类黄酮、木质素和酚类等次生代谢产物[6]。可见,对其深入研究将有助于在分子水平上研究花青素的合成。目前,蓝莓的研究多以提取花青素和抗氧化研究为主[2],对长白山蓝莓中花青素合成关键酶PAL的研究尚未见报道。本研究通过以长白山野生蓝莓为材料,以其中的花青素生物合成关键酶PAL为研究目标,利用RT-PCR法克隆蓝莓花青素合成的关键酶基因PAL的全长cDNA序列,命名为Bb-PAL,并构建PAL表达载体。为以后将PAL基因转入常规生长周期短的植物,提高被转植物的花青素含量和花青素的调控研究提供技术支撑,也为长白山资源的开发利用及花青素保健品开发提供一定的理论基础。1.1材料1.1.1植物材料长白山蓝莓果实(成熟前期)。1.1.2菌株与载体E.coliDH5α,克隆载体pMD18-T,表达载体PET-20b(+)由吉林农业科技学院生物技术实验室提供。1.1.3试剂10kbGeneRulerDNALadderMix购自Fermentas公司、限制性内切酶XbaI和HindⅢ、反转录试剂盒、RNase、TaqDNA聚合酶、TrizolRNA提取试剂盒均购自Invitrogen公司,凝胶回收试剂盒购自北京鼎国生物试剂公司,T4DNA连接酶购自NewEnglandBiolabs(NEB)公司。通用植物总RNA提取试剂盒购自上海Bioteke生物技术有限公司,其他试剂均为国产分析纯。1.2蓝莓RNA的提取同时采用改良的CTAB法[7]和Trizol试剂盒法[8]作对照。通用植物总RNA提取试剂盒法提取步骤如下:1)依次按说明书操作,首先称取100mg新鲜蓝莓果皮于液氮中快速研磨。2)将样品转移至1.5mL离心管中,加入1mL裂解液PL并轻轻颠倒混匀,置于65℃条件下孵育5min,确保核蛋白体被完全分解。3)室温下12000r/min离心10min,并小心将上清转入RNasefree过滤柱中。4)4℃,10000r/min离心45s。将含有总RNA的下滤液收集于收集管中。5)加入1倍体积的70%乙醇于收集管中,颠倒混匀。6)4℃,10000r/min离心45s,弃掉废液并将吸附柱重新放回收集管中。7)加入500μL去蛋白液RE于吸附柱,4℃,12000r/min离心45s,弃掉下部废液。8)加入700μL漂洗液RW于吸附柱,4℃,12000r/min离心60s,弃掉下部废液。9)加入500μL漂洗液RW于吸附柱,4℃,12000r/min离心60s,弃掉下部废液。10)将吸附柱RA放回空收集管中,4℃,12000r/min离心2min,尽量去除漂洗液中残留乙醇。11)将吸附柱RA放入新RNasefree离心管中,加70μLRNasefreewater,于室温放置2min,并4℃,12000r/min离心1min。12)分别用紫外分光光度计和非变性琼脂糖凝胶核酸电泳鉴定。1.3cDNA第一链和全长PAL基因产物的获得反转录试剂盒对mRNA反转录合成PAL基因的cDNA,再以此cDNA为模板通过常规PCR扩增PAL基因。根据GenBank数据库中登录的欧洲越橘的PAL基因全长信息(AY123770.1)设计带有XbaI和HindⅢ酶切位点的克隆引物,基因大小为258bp,由生工生物工程(上海)股份有限公司合成。克隆引物:F,5’-CGTCTAGAGTCTCATGGACAACACTCGATTAG-3’;R,5’-CGAAGCTTTTAGGTGATCCACGTCCTGGT-3’。反应条件:94℃预变性5min;94℃变性30s,55℃退火30s,72℃延伸1min,35个循环;72℃延伸10min。PCR反应结束后,进行1%Agarose凝胶电泳,然后切胶回收目的DNA片段[9]。1.4目的片段连入T载体切胶回收目的基因并与pMD18-T载体以3∶1的比例连接。pMD18-TVector1μL,连接反应buffer(2×)5μL,PAL基因片段(20ng/μL)3μL,T4DNA连接酶1μL,混匀,16℃进行连接反应16h。1.5转化克隆的筛选与鉴定将连接产物转入大肠杆菌DH5α感受态细胞,在含氨苄青霉素、X-gal及IPTG的LB抗性固体培养基平板上37℃倒置选择培养过夜筛选白色菌落,用碱裂解法提取质粒并进行酶切鉴定[10]。1.6PAL基因表达载体的构建将表达载体pET-20b(+)用XbaI和HindⅢ双酶切并连接PAL目的基因,转化大肠杆菌BL21(DE3)感受态细胞中在氨苄青霉素抗性平板上筛选阳性克隆并进行酶切和PCR鉴定[11-12]。在pET-20b(+)载体上的检测引物:F,5’-CGGTAAAGCTCATCAGCGTGGTC-3’;R,5’-CGAAGCTTTTAGGTGATCCACGTCCTGGT-3’(PAL的克隆引物R)。2.1蓝莓RNA的获得当尝试用通用植物总RNA提取试剂盒提取新鲜蓝莓时,电泳结果看到明显的2条28S、18S条带,条带清晰,RNA无降解,有时候也可以看到5S带。除此之外,RNA浓度和纯度也较好(图1)。OD260/OD280=1.95,OD260/OD230=2.28。因此,此法适合蓝莓总RNA的提取。试验也表明,不同采摘季节蓝莓中的总RNA含量不同,选择在蓝莓的最佳采摘季节采摘,尤其是果实成熟初期并选择较新鲜的蓝莓,提取的RNA质量优、含量高。2.2PAL目的基因的获得以蓝莓果皮RNA反转录的cDNA为模板,扩增1条270bp左右的单一特异性条带(图2),且未加模板的阴性对照无此条带产生,产物与预期结果一致。PAL目的基因大小为258bp,加上限制性内切酶和保护碱基,预期片段大于目的基因片段,可见,成功获得了PAL的克隆基因。2.3克隆和表达载体的构建及鉴定结果显示,获得与载体大小类似的2900bp左右的大片段和目的基因小片段(图3a)。回收的目的片段被连接到用XbaI和HindIII进行双酶切的表达载体pET-20b(+)上,转化大肠杆菌BL21(DE3)感受态细胞中在氨苄青霉素抗性平板上筛选阳性克隆,并进行酶切和PCR鉴定。酶切鉴定结果表明,获得类似pET-20b(+)载体的3700bp大片段和目的基因大小的小片段(图3b),初步判断表达载体被成功构建。为了进一步验证目的基因的连接和表达载体构建情况,对表达载体进行PCR鉴定,反向引物R用PAL的反向克隆引物R,检测的正向引物F根据pET-20b(+)载体设计,且正向引物F链接至pET-20b(+)载体上XbaI酶切位点的长度是695bp,加上目的基因258bp,预期片段大小是1000bp。从图4可明显看出,获得预期大小1000bp的片段。由此可见,已成功构建出携带蓝莓PAL目的基因的表达载体,命名为pET-Bb-PAL。注:M,10kbGeneRulerDNALadderMix;a,b,c,d:阴性对照;e,f:PCR产物。Note:M,10kbGeneRulerDNALadderMix;a,b,c,d:Negativecontrol,e,f:ProductsofPCR.图4重组表达载体的PCR鉴定Fig.4PCRdetectionofrecombinantexpressionvector3结论与讨论作为植物次生代谢产物之一的花青素,由于其在清除自由基、抗氧化及预防心血管疾病等方面的重要作用,日益受到关注。其研究也从组织、细胞水平深入到分子水平,尤其是花青素生物合成代谢途径的研究。目前,国内外已有多种植物花青素代谢途径的研究报道。其中一部分研究是集中在环境因素对花青素生物合成影响的研究,如光照、温度、果实套袋的影响,此外,激素、酶和糖的添加也对花青素的生物合成带来影响[13]。另一部分是关于花青素合成的关键酶基因结构和生物学信息及基因表达的研究,包括结构基因和调节基因的研究。其中,结构基因的研究越来越广泛和深入,主要是编码合成代谢相关的酶类基因的研究。这些酶主要有苯丙氨酸解氨酶PAL、花青素合酶(AnthocyanidinsynthaseANS/Leueoanthoeyanidindioxygenase,LODX)、黄烷酮3-羟化酶(Flavanone3-hydroxylase,F3H)、类黄酮-3’-羟化酶F3’H与类黄酮-3’,5’-羟化酶(Flavonoid-3’,5’-hydroxylase,F3’5’H)和二氢黄酮醇4-还原酶(Dihydroflavonol-4-reductase,DFR)[14-15]。目前,已经有多种花青素合成途径中关键酶基因的定位和表达被研究,主要集中在大豆、芜菁、蓝莓和拟南芥等植物上[16]。对苯丙氨酸解氨酶基因的研究也涉及多种植物,许志茹等[17]研究发现,用352nm的UV-A能诱导津田芜菁和赤丸芜菁苯丙氨酸解氨酶基因的表达且表达量与处理时间正相关。而银杏[18]、夹竹[19]、红叶芥[20]、海桐[21]等植物PAL的基因克隆也相继被研究。苯丙氨酸解氨酶作为催化合成花青素的关键限速酶之一,在蓝莓花青素的合成中起至关重要的作用。且存在于植物表皮中的花青素,在低温、光照等环境变化时其花青素的合成也在不断变化。吉林长白山特有的自然环境和丰富资源,不但能使得蓝莓的果皮富含花青素,也能通过蓝莓花青素合成酶的研究为长白山资源的开发和提高蓝莓的附加值及物种进化提供理论依据。本研究通过不同方法提取蓝莓总RNA,结果表明,改良CTAB法获得的总RNA纯度相对偏低、杂质较多,可能由于蓝莓果皮中含有的多糖和酚类物质较多,这些物质易与RNA产生共沉淀,影响试验结果。Trizol试剂盒法能克服蓝莓多糖、多酚的特点,提取出较纯净总RNA,优于CTAB法的RNA提取。但条带亮度较小,表明总RNA浓度较低。而通用植物总RNA提取试剂盒提取的总RNA条带清晰,浓度较高,因此,较适合用于蓝莓总RNA的提取。同时,本研究通过成功克隆花青素生物合成关键酶PAL基因,进而构建了PAL基因表达载体,为实现其他植物的PAL基因转移和提高花青素含量研究奠定基础,也为花青素合成及其调控机理的阐明提供一些依据,促进长白山种质资源的保存与充分利用。[参考文献](责任编辑:刘忠丽)CloningofBlueberryPhenylalanineAmmonialyaseGeneandConstructingofExpressionVectorXUYawei,YINRui,WANGJunling(CollegeofBioengineering,JilinAgriculturalScienceandTechnologyCollege,Jilin,Jilin132101,China)Abstract:TodeeplyexploretheexpressionandfunctionofgenePAL,totalRNAofblueberryfruitwasextracted6byextractingkitinuniversalplanttotalRNA,andrelatedprimersweredesignedaccordingtothehomologousgenes,codinggeneofphenylalanineammonialyasewasclonedusingreversetranscriptionPCR,andthenwasconnectedtopMD18-Tvectortoconstructcloningvectorandidentifybyrestrictionenzymeanalysismethod.ThenPALgenewasligatedtopET-20b(+)vectortoacquireexpressionvector,andbothmethodsofrestrictionenzymeanalysisandPCRwasconductedfordetection.Theresultindicatedthat258bpbandofPALwasgotandtheexpressionvectorwasestablishedsuccessfully.Keywords:blueberry;phenylalanineammonialyase;clone;expressionvector[收稿日期]2015-07-01;2015-11-28修回[基金项目]吉林农业科技学院专项基金项目“长白山重点实验室”[吉农院合字(2012)第714号][作者简介]徐亚维(1974-),女,副教授,博士,从事基因工程研究。E-mail:xuyaweilucky@163.com[文章编号]1001-3601(2015)12-0656-0026-04[中图分类号]S663.9[文献标识码]A2.3克隆和表达载体的构建及鉴定结果显示,获得与载体大小类似的2900bp左右的大片段和目的基因小片段(图3a)。回收的目的片段被连接到用XbaI和HindIII进行双酶切的表达载体pET-20b(+)上,转化大肠杆菌BL21(DE3)感受态细胞中在氨苄青霉素抗性平板上筛选阳性克隆,并进行酶切和PCR鉴定。酶切鉴定结果表明,获得类似pET-20b(+)载体的3700bp大片段和目的基因大小的小片段(图3b),初步判断表达载体被成功构建。为了进一步验证目的基因的连接和表达载体构建情况,对表达载体进行PCR鉴定,反向引物R用PAL的反向克隆引物R,检测的正向引物F根据pET-20b(+)载体设计,且正向引物F链接至pET-20b(+)载体上XbaI酶切位点的长度是695bp,加上目的基因258bp,预期片段大小是1000bp。从图4可明显看出,获得预期大小1000bp的片段。由此可见,已成功构建出携带蓝莓PAL目的基因的表达载体,命名为pET-Bb-PAL。作为植物次生代谢产物之一的花青素,由于其在清除自由基、抗氧化及预防心血管疾病等方面的重要作用,日益受到关注。其研究也从组织、细胞水平深入到分子水平,尤其是花青素生物合成代谢途径的研究。目前,国内外已有多种植物花青素代谢途径的研究报道。其中一部分研究是集中在环境因素对花青素生物合成影响的研究,如光照、温度、果实套袋的影响,此外,激素、酶和糖的添加也对花青素的生物合成带来影响[13]。另一部分是关于花青素合成的关键酶基因结构和生物学信息及基因表达的研究,包括结构基因和调节基因的研究。其中,结构基因的研究越来越广泛和深入,主要是编码合成代谢相关的酶类基因的研究。这些酶主要有苯丙氨酸解氨酶PAL、花青素合酶(AnthocyanidinsynthaseANS/Leueoanthoeyanidindioxygenase,LODX)、黄烷酮3-羟化酶(Flavanone3-hydroxylase,F3H)、类黄酮-3’-羟化酶F3’H与类黄酮-3’,5’-羟化酶(Flavonoid-3’,5’-hydroxylase,F3’5’H)和二氢黄酮醇4-还原酶(Dihydroflavonol-4-reductase,DFR)[14-15]。目前,已经有多种花青素合成途径中关键酶基因的定位和表达被研究,主要集中在大豆、芜菁、蓝莓和拟南芥等植物上[16]。对苯丙氨酸解氨酶基因的研究也涉及多种植物,许志茹等[17]研究发现,用352nm的UV-A能诱导津田芜菁和赤丸芜菁苯丙氨酸解氨酶基因的表达且表达量与处理时间正相关。而银杏[18]、夹竹[19]、红叶芥[20]、海桐[21]等植物PAL的基因克隆也相继被研究。苯丙氨酸解氨酶作为催化合成花青素的关键限速酶之一,在蓝莓花青素的合成中起至关重要的作用。且存在于植物表皮中的花青素,在低温、光照等环境变化时其花青素的合成也在不断变化。吉林长白山特有的自然环境和丰富资源,不但能使得蓝莓的果皮富含花青素,也能通过蓝莓花青素合成酶的研究为长白山资源的开发和提高蓝莓的附加值及物种进化提供理论依据。本研究通过不同方法提取蓝莓总RNA,结果表明,改良CTAB法获得的总RNA纯度相对偏低、杂质较多,可能由于蓝莓果皮中含有的多糖和酚类物质较多,这些物质易与RNA产生共沉淀,影响试验结果。Trizol试剂盒法能克服蓝莓多糖、多酚的特点,提取出较纯净总RNA,优于CTAB法的RNA提取。但条带亮度较小,表明总RNA浓度较低。而通用植物总RNA提取试剂盒提取的总RNA条带清晰,浓度较高,因此,较适合用于蓝莓总RNA的提取。同时,本研究通过成功克隆花青素生物合成关键酶PAL基因,进而构建了PAL基因表达载体,为实现其他植物的PAL基因转移和提高花青素含量研究奠定基础,也为花青素合成及其调控机理的阐明提供一些依据,促进长白山种质资源的保存与充分利用。【相关文献】[1]王辉,王鹏云,王蜀,等.我国蓝莓发展的现状及前景展望[J].中国农业现代化研究,2008,29(2):250-253.[2]胡雅馨,李京,惠伯栎,等.蓝莓果实中的主要营养及花青素成分的研究[J].食品科学,2008,21(5):611-618.[3]曹春燕.一品红PAL基因克隆与表达的初步研究[D].扬州:扬州大学,2009.[4]庞红霞,祝长青,覃建兵.植物花青素生物合成相关基因研究进展[J].种子,2010,29(3):60-64.[5]葛翠莲,黄春辉,徐小彪.果实花青素生物合成研究进展[J].园艺学报,2012,39(9):1655-1664.[6]李珍,刘金兵,刁卫平,等.辣椒花青素生物合成相关基因的表达分析研究[J].华北农学报,2014,29(4):87-92.[7]王关林,方宏筠.植物基因工程[M].北京:科学出版社,2002:744.[8]赵继荣,毕阳,刘红霞,等.Trizol法提取厚皮甜瓜果实RNA条件的筛选[J].甘肃农业大学学报,2009,44(2):56-59.[9]萨姆布鲁克J,弗里奇EF,曼尼阿蒂斯T.分子克隆实验指南[M].北京:科学出版社,1993:19-23.[10]YoonH,YouYH,KimYE,etal.CloningandmRNAexpressionanalysisofthegeneencodingphenylalanineammonia-lyaseoftheectomycorrhizalfungusTricholomamatsutake[J].JMicrobiolBiotechnol,2013,23(8):1055-1059.[11]LauraJaakola,KaisuMtt,AnnaMariaPirttil,etal.ExpressionofGenesInvolvedinAnthocyaninBiosynthesisinRelationtoAnthocyanin,Proanthocyanidin,andFlavonolLevelsduringBilberryFruitDevelopment[J].PlantPhysiology,2002,130(2):729-739.[12]LiC,FengZ,BaiY,etal.Molecularcloningandprokaryoticexpressionofphenylalanineammonia-lyasegeneFdPALfromFagopyrumdibotrys[J].ChinajournalofChinesemateriamedica,2011,36(23):3238-3243.[13]郭成栓,欧阳蒲月,杜敏.培养条件对植物细胞培养生产花青素影响的研究进展[J].安徽农业科学,2010,38(12):6109-6111.[14]周生茂,王玲平,向珣.山药ANS基因的克隆和分子特性及其与花青素积累的关系[J].园艺学报,2009,36(9):1317-1326.[15]HUYongsheng,ZHANGLei,DIPeng,etal.CloningandInductionofPhenylalanineAmmonia-lyaseGenefromSalviamiltiorrhizaandItsEffectonHydrophilicPhenolicAcidsLevels[J].ChineseJournalofNaturalMedicines,2009,7(6):449-457.[16]李春雷,崔国新,孙燕,等.芜菁花青素合成酶基因的克隆、序列分析及表达[J].生物技术通讯,2009,20(10):66-74.[17]许志茹,崔国新,李春雷,等.津田芜菁和赤丸芜菁苯丙氨酸解氨酶基因的克隆和表达[J].植物生理学通讯,2008,44(3):485-490.[18]陈新,万德光,严铸云,等.裴瑾银杏苯丙氨酸解氨酶(PAL)的基因克隆[J].成都中医药大学学报,2004,27(1):32-34.[19]王燕,许锋,杜何为,等.夹竹桃苯丙氨酸解氨酶的基因克隆与序列分析[J].华北农学报,2007,22(4):19-24.[20]孙梓健,汤青林,宋明,等.红叶芥低温胁迫下苯丙氨酸解氨酶活性及其基因的克隆表达[J].西南大学学报:自然科学版,2010,32(2):90-94.[21]XUFeng,CHENLiuji,CAIRong.CloningandSequenceAnalysisofaPhenylalanineAmmonia-lyasecDNAfromPittosporumtobira[J].ActaAgriculturaeBoreali-occidentalisSinica,2008,17(2):218-224.',)
提供蓝莓苯丙氨酸解氨酶基因的克隆与表达载体构建会员下载,编号:1700748066,格式为 docx,文件大小为9页,请使用软件:wps,office word 进行编辑,PPT模板中文字,图片,动画效果均可修改,PPT模板下载后图片无水印,更多精品PPT素材下载尽在某某PPT网。所有作品均是用户自行上传分享并拥有版权或使用权,仅供网友学习交流,未经上传用户书面授权,请勿作他用。若您的权利被侵害,请联系963098962@qq.com进行删除处理。

 下载
下载 下载
下载 下载
下载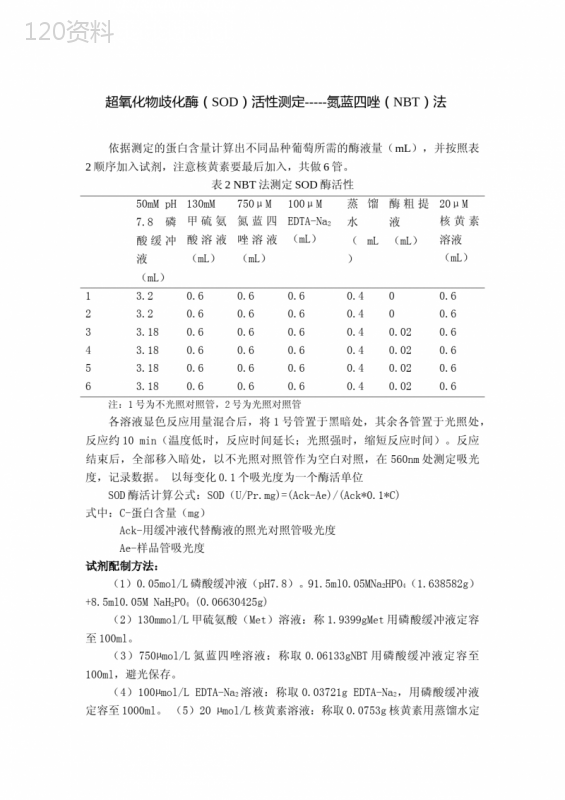 下载
下载 下载
下载 下载
下载 下载
下载 下载
下载